Infertilidad Femenina
Infertilidad femenina: diagnóstico y tratamiento
El diagnóstico de infertilidad femenina es significativamente más complejo que el diagnóstico de infertilidad masculina. La prueba de infertilidad de un hombre puede ser tan simple como el análisis de semen, sin embargo, una mujer puede someterse a pruebas y pruebas de detección exhaustivas, lo que puede o no resultar en un diagnóstico claro. Las mujeres no solo proporcionan el óvulo, sino que también proporcionan un entorno adecuado para que el embrión se convierta en un ser humano viable. Aunque las causas de infertilidad femenina generalmente están relacionadas con los óvulos de la mujer, varias otras afecciones ováricas y / o uterinas pueden interferir con la capacidad de concebir naturalmente. Existen algunas pautas establecidas para diagnosticar la infertilidad femenina primaria, sin embargo, todos los exámenes de infertilidad deben comenzar con un historial médico preciso. Las siguientes preguntas pueden ayudar a guiar el diagnóstico y el tratamiento de la infertilidad femenina primaria:
- Alguna vez has tenido un aborto espontáneo? Si es así, ¿en qué momento del embarazo ocurrió el aborto espontáneo?
- Tiene antecedentes familiares de infertilidad?
- Tienes ciclos menstruales regulares?
- Ha sido examinado recientemente para detectar enfermedades infecciosas, incluidas las enfermedades de transmisión sexual?
- Tienes una mascota?
Las respuestas a cada una de estas preguntas pueden proporcionar información importante al especialista en fertilidad. Por ejemplo, tener mascotas puede aumentar la probabilidad de una mujer de contraer infecciones que pueden causar infertilidad, como la toxoplasmosis. Del mismo modo, un historial familiar de infertilidad podría señalar causas genéticas de infertilidad. Durante cualquier estudio de infertilidad, los pacientes deben conformarse con nada menos que un historial médico completo. Estas preguntas pueden ayudar a identificar las posibles causas de infertilidad, pero el siguiente paso es evaluar la fisiología reproductiva tanto del paciente masculino como femenino. En particular, las pruebas hormonales pueden proporcionar información sobre la función ovárica de una mujer y ayudar a guiar el tratamiento.
La mayoría de los casos de infertilidad femenina se deben a problemas con la ovulación. La anovulación (la ausencia de ovulación) sugiere que hay un problema en alguna etapa del ciclo ovárico. Una señal de que una mujer puede no estar ovulando sería períodos menstruales irregulares o ausentes. La mayoría de los casos de anovulación se deben a un problema hormonal del hipotálamo o la glándula pituitaria. La glándula pituitaria no solo libera FSH y LH, sino que también controla la liberación de muchas otras hormonas, como la hormona estimulante de la tiroides y la prolactina. Por lo tanto, una variedad de trastornos de la glándula pituitaria pueden interferir con la capacidad de la mujer para concebir. En algunos casos, los folículos en crecimiento pueden no alcanzar la ovulación debido a problemas hormonales. En otros casos, una mujer puede ovular, pero los óvulos no son capaces de fertilizar. Algunas de estas condiciones se discutirán con más detalle más adelante en este capítulo.
Otras causas comunes de infertilidad femenina incluyen las siguientes:
- Trompas de Falopio dañadas: las trompas de Falopio bloqueadas debido a una enfermedad inflamatoria pélvica, endometriosis o un embarazo ectópico previo, así como la extracción quirúrgica de una trompa de Falopio pueden afectar significativamente la fertilidad de una mujer. La trompa de Falopio es el sitio de la fertilización. Por lo tanto, si las trompas de Falopio están bloqueadas, dañadas o faltantes, entonces la fertilización no puede ocurrir naturalmente.
- Problemas físicos con el útero: el útero es donde el embrión se convierte en un bebé. Por lo tanto, las afecciones, como los fibromas o pólipos, que interfieren con la implantación de un embrión en la pared uterina o con el desarrollo del feto no son favorables para el embarazo.
- Debilidad cervical: cualquier afección que afecte la capacidad del cuello uterino para permanecer cerrada puede evitar que una mujer lleve un feto a término.
- Enfermedades infecciosas: una variedad de enfermedades infecciosas de transmisión sexual y no sexual pueden provocar el fracaso de la implantación o la pérdida de un embarazo. Afortunadamente, la mayoría de estas enfermedades son relativamente fáciles de evaluar durante un examen de infertilidad estándar.
- Problemas inmunológicos: un sistema inmunitario anormal puede provocar que el cuerpo de una mujer ataque a un embrión de implantación, lo que provoca un fallo de implantación o una pérdida temprana del embarazo. Los anticuerpos antiespermáticos también pueden estar presentes en las secreciones vaginales o en la sangre, lo que puede evitar la fertilización.
- Trastornos de la coagulación de la sangre: la trombofilia (una afección que aumenta la posibilidad de coagulación de la sangre) puede aumentar el riesgo de aborto espontáneo de una mujer. Los trastornos trombofílicos también pueden interferir con la implantación de embriones, porque se puede formar un coágulo de sangre en el sitio de implantación. Muchas trombofilias hereditarias pueden identificarse mediante análisis de sangre de rutina.
- Estrés: el estrés físico y emocional puede causar infertilidad femenina. El estrés puede tener varias manifestaciones fisiológicas, lo que dificulta la concepción.
- Estilo de vida: los hábitos de vida de una mujer pueden afectar directamente su capacidad de concebir. Varios estudios han establecido vínculos entre fumar cigarrillos y la infertilidad. Del mismo modo, se ha encontrado que el consumo de alcohol tiene una asociación dependiente de la dosis con la infertilidad.
También hay una serie de afecciones ginecológicas que con frecuencia conducen a la infertilidad femenina, incluido el síndrome de ovario poliquístico, endometriosis y fibromas uterinos.
El envejecimiento disminuye las posibilidades de una mujer de tener un bebé, de las siguientes maneras:
- La capacidad de los ovarios de una mujer para liberar óvulos listos para la fertilización disminuye con la edad.
- La salud de los óvulos de una mujer disminuye con la edad. Con edades avanzadas, se observan más problemas genéticos debido al envejecimiento de los huevos.
- A medida que una mujer envejece, es más probable que tenga problemas de salud que pueden interferir con la fertilidad.
- A medida que una mujer envejece, su riesgo de tener un aborto espontáneo aumenta.
¿Cuánto tiempo deberían las mujeres intentar quedar embarazadas antes de llamar a sus médicos?
La mayoría de las mujeres sanas menores de 30 años no deberían preocuparse por la infertilidad a menos que hayan estado tratando de quedar embarazadas durante al menos un año. En este punto, las mujeres deben hablar con sus médicos sobre una evaluación de fertilidad. En algunos casos, las mujeres deben hablar con sus médicos antes. Las mujeres de 30 años que han estado tratando de quedar embarazadas durante seis meses deben hablar con sus médicos lo antes posible. Las posibilidades de que una mujer tenga un bebé disminuyen rápidamente cada año después de los 30 años. Por eso, es especialmente importante realizar una evaluación de fertilidad completa y oportuna.
¿Dónde empezar?
El primer paso en las pruebas y evaluaciones de infertilidad comienza en la oficina de su ginecólogo. Una ecografía de línea de base (ecografía) será útil para el seguimiento del folículo antral (para ver cuántos óvulos potenciales contiene cada ovario). Esto debe hacerse el día 2 o el día 3 de su período menstrual. Del mismo modo, en este mismo día, debe solicitar una prueba hormonal para evaluar su función ovárica, incluida FSH, LH, estradiol, prolactina, TSH y AMH. En función de los resultados de estas pruebas, podremos realizar una evaluación y decidir el curso de acción más apropiado.
¿Cómo afecta la edad a la fertilidad?
La edad es uno de los factores más críticos cuando se considera la probabilidad de éxito de una mujer durante un tratamiento de FIV. No es la “edad” como un número per se lo que afecta la capacidad de una mujer para concebir, sino que es el impacto sobre las reservas ováricas y la calidad de los ovocitos lo que afecta la capacidad de la mujer para concebir. Cada mujer nace con un conjunto limitado de reservas ováricas y la cantidad de óvulos en las reservas disminuye con la edad. No hay nueva producción de ovocitos en los ovarios, por lo tanto, la fertilidad disminuye cada mes con cada ciclo menstrual. La siguiente figura muestra la cantidad de reservas ováricas por edad:
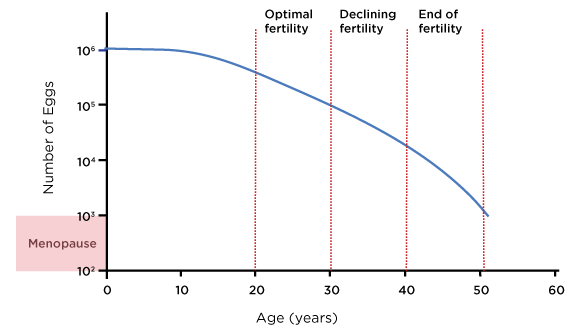
Toda mujer nace con aproximadamente 1 millón de folículos en las reservas ováricas (un folículo es un quiste que contiene el óvulo). Una vez que la menstruación comienza en la pubertad, las reservas ováricas comienzan a disminuir con cada ciclo menstrual.
Alrededor de los 30 años, las reservas ováricas caen al 10% de lo que eran al nacer. En otras palabras, entre la pubertad y la edad de 30 años, una mujer pierde el 90% de sus reservas ováricas y la disminución se vuelve aún más aguda después. Entre las edades de 40 y 50 años, las reservas ováricas habrán disminuido mucho y la calidad de las reservas hará que el embarazo sea muy difícil de lograr.
La infertilidad femenina desde una perspectiva académica
Escrito por Asst. Prof. Dr. Ahmet Ozyigit
I. Introducción
La infertilidad se define en general como la incapacidad de concebir durante al menos un año mientras se mantiene una relación sexual regular sin utilizar ningún método anticonceptivo (1). Concebir en sí mismo no es una definición suficiente de fertilidad; por lo tanto, las mujeres que pueden concebir pero no pueden llevar el embarazo a término también pueden incluirse en la definición de infertilidad (2). Dado que la edad de una mujer es probablemente el factor más importante que afecta su capacidad de concebir, las mujeres mayores de 35 años pueden ser consideradas para la evaluación de fertilidad después de seis meses de tener relaciones sexuales regulares sin embarazo (3). Además de la edad, hay una serie de factores que pueden interferir potencialmente con la fertilidad de una mujer. Por ubicación anatómica, las causas de infertilidad femenina pueden clasificarse en términos generales como factores ovulatorios, factores tubarios / peritoneales, factores uterinos, factores cervicales y factores vaginales. Cada factor puede interferir potencialmente con la capacidad de una mujer para concebir y / o mantener el embarazo a término. Si consideramos el embarazo como un proceso que implica una reacción en cadena de todos estos factores, entre estos, los factores ovulatorios pueden percibirse como el cerebro de toda la operación dado que ninguna ovulación (anovulación) simplemente hará que el resto del proceso del embarazo obsoleto. Estudiar los eventos en la reproducción femenina que conducen a la ovulación del óvulo, permitiendo así que ocurra la fertilización, nos ayudará a evaluar mejor los problemas de la ovulación y a crear soluciones de tratamiento apropiadas.
II. Antecedentes históricos
Nuestra comprensión de la anovulación y su impacto en la infertilidad se remonta al trabajo original de Crowe et. Alabama. donde descubren el papel de la glándula pituitaria en la reproducción femenina y masculina. En 1910, los autores estudian los efectos de la ablación parcial de la glándula pituitaria en perros y cachorros adultos, donde encuentran que en los perros adultos, el resultado es la atrofia de los órganos genitales, mientras que en los cachorros, observan la perpetuación del infantilismo y la insuficiencia sexual ( 4) Unos años más tarde, un nuevo descubrimiento proviene de Aschner con respecto a la interacción hipotálamo-hipófisis. La propuesta de Aschner se basaba en sus propias observaciones de que la existencia de lesiones entre el hipotálamo y la glándula pituitaria debido a una lesión en la cabeza resultó en hipopituitarismo y atrofia gonadal (5,6). Estos primeros estudios sobre la glándula pituitaria sentaron las bases para futuras investigaciones y estudios clínicos. En 1926, el estudio de Zondek llevó la investigación de campo un paso más allá y reveló que los animales inmaduros exhibieron un rápido desarrollo de la pubertad sexual cuando recibieron un implante de la pituitaria anterior de animales adultos (7). En el mismo año, Smith también demostró que la implantación diaria de tejido de la glándula pituitaria de ratones, gatos, ratas, conejos y conejillos de indias en ratas y ratones hembras inmaduras causó el agrandamiento de los ovarios y la superovulación (8). Finalmente, en 1967, el vínculo entre el hipotálamo y la pituitaria fue pronunciado con bases sólidas por Guillemin. Su estudio reveló que la GnRH, que se sintetiza y libera en el hipotálamo, controla la liberación de gonadotrofinas (FSH y LH) de la pituitaria para el crecimiento del folículo (9). Hoy, comprendemos mejor el papel de la glándula pituitaria en la ovulación y, por lo tanto, sus posibles efectos sobre la infertilidad femenina.
III. La parte de la glándula pituitaria en la fertilidad femenina
La glándula pituitaria funciona como intermediario entre el hipotálamo y los órganos diana. Se compone de dos secciones separadas; la adenohipófisis, incluidos los lóbulos anterior e intermedio, y la neurohipófisis, que consiste en el lóbulo posterior. La adenohipófisis está compuesta por seis células endocrinas. Estos son somatotropos, lactotropos, tirotrofos, corticotrofos, gonadotropos y melanotropos (10, 11). Los somatótrofos secretan la hormona del crecimiento y regulan el crecimiento y el metabolismo; los lactotropos producen la hormona prolactina, que regula la producción de leche en las mujeres; los tirotrofos producen la hormona estimulante de la tiroides (TSH) que estimula la hormona tiroidea y el desarrollo del folículo tiroideo, los corticotropos regulan la función metabólica, los melanótopos regulan la producción de melanina y finalmente, los gonadotropos son responsables de la producción de la hormona estimulante del folículo (FSH) y la hormona luteneizante (LH) en respuesta a GnRH, que mantienen la función reproductiva (10,11). TSH, LH y FSH son glucoproteínas compuestas de una subunidad α común (αGSU) junto con una subunidad β específica de la hormona (11,12). Jameson et al., En su estudio de 1989, han demostrado que en algunas neoplasias, tiende a haber un control menos riguroso de la expresión del gen α en comparación con la expresión del gen β (13). Esto también se evidencia en un estudio posterior, que muestra que el estradiol a nivel de la glándula pituitaria no regula directamente los niveles de estado estable de mRNA para las subunidades α, mientras que existe una relación negativa directa con las subunidades β (14).
IV. Investigación y trabajo clínico
La FSH, que es una producción directa de la glándula pituitaria, desempeña un papel en el ovario en la maduración folicular, así como en la producción de estrógeno en las células granulosas (15). LH, por otro lado, controla la duración y la secuencia de un ciclo menstrual. La hormona luetinizante también controla la producción ovárica de estrógeno y progesterona y prepara el útero para una implantación exitosa del embrión (16). Como respuesta a la GnRH, ambas hormonas se secretan de forma pulsátil, pero los pulsos de la FSH son más sutiles en comparación con la LH, debido a la vida media circulatoria prolongada de la FSH, que se atribuye a las diferencias en la composición de su lado de carbohidratos. cadenas (15). Los niveles séricos de las mediciones de FSH y LH ayudan a los médicos a comprender la ferilidad femenina y la función ovárica. Un nivel elevado de FSH, por ejemplo, corresponde a una función gonadal reducida, mientras que un nivel sérico normal indica una función normal. Un nivel elevado de LH junto con un nivel normal de FSH puede ser una indicación de síndrome de ovario poliquístico (17). El conocimiento de estas mediciones ha permitido a los médicos tomar las medidas adecuadas al ofrecer tratamientos de fertilidad. Con la ayuda de la investigación sobre la función de la hipófisis y la interacción hipotálamo-hipófisis, hay varias alternativas de tratamiento disponibles para parejas infértiles con problemas ovulatorios. Las siguientes son categorías borad de estas opciones de tratamiento:
1 – Citrato de clomifeno: el citrato de clomifeno es a menudo la primera opción de inducción de la ovulación en mujeres con problemas ovulatorios y niveles normales de estrógenos. Aunque no hay consenso sobre si el clomifeno tiene un efecto estogénico o antiestrogénico a nivel pituitario y ovárico, se ha informado que causa un aumento de más del cincuenta por ciento en el nivel endógeno de FSH (18). Con el aumento de los niveles de FSH, el tratamiento con clomifeno tiene como objetivo reclutar un folículo dominante y, por lo tanto, generar la ovulación para aumentar las posibilidades de embarazo. El citrato de climofene se puede usar en el ciclo natural de una mujer con el momento de la relación sexual y también se puede usar en un ciclo de inseminación intrauterina (IUI). Un ciclo de IUI puede basarse en un solo uso de citrato de clomifeno o puede usarse junto con suplementos de gonadotropina.
2 – Gonadotrofinas: las mujeres que no responden al climofene o que han agotado las reservas ováricas tienen una mayor probabilidad de concepción a través de la inyección directa de gonadotropinas. La introducción de FSH en los primeros días del ciclo menstrual, es decir, la fase folicular, prolongará la fase de reclutamiento del folículo y, por lo tanto, permitirá que se recluten más folículos para el desarrollo. Un mayor número de folículos reclutados para la ovulación aumentará las posibilidades de concepción, pero también aumentará el riesgo de un embarazo múltiple. Con el uso de gonadotropinas, se puede implementar un protocolo de agonista de GnRH o antagonista de GnRH. Un protocolo agonista, que tiende a ser más popular, ayuda a suprimir las concentraciones de FSH y LH antes de la inducción de la ovulación, y evita la luteinización prematura (19). Se puede preferir un protocolo antagonista para las mujeres pobres que responden con reservas ováricas inferiores (20). Los protocolos antagonistas se han asociado con menores requisitos de gonadotropina y ciclos de estimulación más cortos en pacientes con poca respuesta (21).
El uso de gonadotropinas puede ser en forma de FSH pura o una combinación de FSH y LH. Si bien la suplementación con FSH sola es suficiente para el reclutamiento y crecimiento del folículo, pequeñas cantidades de LH pueden ser útiles para proporcionar una secreción adecuada de estrógenos y también pueden tener un impacto directo en la estimulación y la modulación de la foliculogénesis (22,23).
V. Conclusión
La investigación continua en el campo de la infertilidad ayuda a los investigadores a proporcionar una mejor explicación de los problemas de infertilidad y también ayuda a los médicos a proporcionar protocolos de tratamiento mejor formulados para sus pacientes. La extensa historia de la investigación sobre el papel de la glándula pituitaria en los órganos reproductivos ha ayudado a formular opciones de tratamiento para parejas infértiles como el citrato de climofene y los suplementos de gonadotropina. Ambos tratamientos se han derivado del principio de síntesis y secreción de hormonas de la glándula pituitaria como respuesta a la GnRH liberada del hipotálamo.
Referencias
- Zabrek EM. Can I get pregnant? The basic infertility workup. Clin Obstet Gynecol 1996; 39: 223-230.
- Gaware. V. M. et al. Female infertility and its treatment by alternative medicine: A review. Journal of Chemical and Pharmaceutical Research, 2009, 1(1):148-162
- Roupa. Z. Et al. Causes of infertility in women at reproductive age. Health Science Journal, 2009 3(2): 80-87
- Crowe SJ, Cushing H and Homans J. Experimental hypophysectomy. Bulletin of Johns Hopkins Hospital, 1910; 21: 127–167
- Lunenfeld, Historical Perspectives in Gonadotrophin Therapy. Human Reproduction Update, 2004, 10(6): 453–467.
- Aschner, B. Ueber die Beziehung zwischen Hypophysis und Genitale. Arch Gyna 1912, (97): 200–227.
- Ludwig M. et al. Ovarian Stimulation: From basic science to clinical application. Reproductive Biomedicine Online, 2002; 5(1): 73-86
- Smith, P. E. Hastening of development of female genital system by daily hemoplastic pituitary transplants. Proc Soc Exp Biol Med, 1926; 24: 1311–1333.
- Zondek, B. Ueber die Hormone des Hypophysenvorderlappens. Klin Wochenschrift, 1930; 9: 245–248.
- Guillemin, R. Chemistry and Physiology of hypothalamic releasing factors for gonadotrophins. International Journal of Fertility, 1967; 12: 359-367
- Nolan, T.E. Regulation of GnRH Receptor mRNA: Interaction of GnRH and Estradiol. Colorado State University, Fort Collins. 1997; ADA333377.
- Zhu X. Molecular physiology of pituitary development: signaling and transcriptional networks. Physiol Rev, 2007; 87:933
- Pierce, J. G, Parsons, T. F, Glycoprotein hormones: structure and function. Annu Rev Biochem, 1981; 50:465–495
- Jameson J.L, Powers A.C, Gallagher G.D and Habener J.F, Enhancer and Promoter Element Interactions Dictate Cyclic Adenosine Monophosphate Mediated and Cell-Specific Expression of the Glycoprotein Hormone oc-Gene. Molecular Endocrinology, 1989; 3: 763-772
- DiGregorio G.B, Nett T.M, Estradiol and progesterone influence the synthesis of gonadotropins in the absence of gonadotropin-releasing hormone in the ewe. Biology of Reproduction, 1995; 53(1): 166-172
- Huhtaniemi I.T, Aittomaki K. Mutations of follicle-stimulating hormone and its receptor: effects on gonadal function, Eur J Endocrinol. 1998; 138(5):473-81.
- Kumar P, Sait S.F. Luteinizing hormone and its dilemma in ovulation induction. J Hum Reprod Sci, 2011; 4(1): 2-7
- Balen A.H, Conway G.S, Kaltsas G, Techatrasak K, Manning P.J, West C, Jacobs H.S, Polycystic ovary syndrome. The spectrum of the disorder in 1741 patients. Hum Reprod, 1995; 10:2107–2111
- Kousta, E, White D.M., and Franks, S. Modern use of clomiphene citrate in induction of ovulation. Human Reproduction Update, 1997; 3(4): 359–365
- Homburg, R. and Insler, V. Ovulation induction in perspective, Human Reproduction Update, 2002; 8(5): 449-462
- Pu, D., Wu, J, and Liu, J. Comparison of GnRH antagonist versus GnRH agonist protocol in poor ovarian responders undergoing IVF, Hum Reprod, 2012; 27(4):1230
- Lainas T.G, Sfontouris I.A, Zorzovilis I.Z, Petsas G.K, Lainas G.T, Alexopoulou E, et al. Flexible GnRH antagonist protocol versus GnRH agonist long protocol in patients with polycystic ovary syndrome treated for IVF: a prospective randomised controlled trial (RCT) Hum Reprod. 2010; 25: 683–689.
- Couzinet B, Lestrat N, Brailly S et al. Stimulation of ovarian follicular maturation with pure follicle-stimulation hormone in women with gonadotropin deficiency. Journal of Clinical Endocrinology and Metabolism, 1988; 66: 522–526.
- Filicori M, Cognigni G.E, Taraborrelli S et al. Luteinizing hormone activity in menotropins optimizes folliculogenesis and treatment in controlled ovarian stimulation. Journal of Clinical Endocrinology and Metabolism, 2001; 87: 1156–1161.

 English
English Français
Français Deutsch
Deutsch Русский
Русский Türkçe
Türkçe العربية
العربية
